Overzicht Aranesp® (darbepoëtine alfa) informatie
Aranesp®
Aranesp® (darbepoëtine alfa) is een geneesmiddel dat wordt ingezet bij de behandeling van
chemotherapie-geïnduceerde anemie. Deze pagina biedt informatie over de indicaties, bijwerkingen, toediening en
vergoeding van Aranesp®.


AmgenPro is uitsluitend bedoeld voor professionele zorgverleners in Nederland
Log in met uw AmgenPro account voor toegang tot content. Of maak een account aan met BIG-nummer en ontdek alle voordelen.
Aranesp® – toepassing
Aranesp® (darbepoëtine alfa) is geïndiceerd voor de behandeling van symptomatische anemie bij volwassen kankerpatiënten met non-myeloïde maligniteiten die chemotherapie krijgen toegediend.1 Anemie wordt gekenmerkt door een laag aantal rode bloedcellen en kan leiden tot symptomen zoals vermoeidheid, zwakte en kortademigheid.
Ziektebeeld en werkingsmechanisme
Aranesp® wordt voorgeschreven om de productie van rode bloedcellen in het beenmerg te stimuleren. Bij patiënten met kanker die chemotherapie toegediend kregen is de oorzaak van anemie multifactorieel. Een tekort aan erytropoëtine en een afgenomen respons van erytroïde voorlopercellen op endogeen erytropoëtine dragen beide significant bij tot de anemie van deze patiënten. Darbepoëtine alfa, de werkzame stof in Aranesp®, werkt op dezelfde manier als het endogene hormoon. Aranesp® stimuleert de erytropoëse via hetzelfde mechanisme als het endogene hormoon en is een erytropoëtische groeifactor die de productie van rode bloedcellen stimuleert door te binden aan de erytropoëtinereceptor op voorlopercellen in het beenmerg. Dit proces verhoogt het aantal rode bloedcellen en verbetert de zuurstoftransportcapaciteit van het bloed. Aranesp® heeft een langere halfwaardetijd dan endogeen erytropoëtine, waardoor het minder frequent hoeft te worden toegediend.1
Bijwerkingen bij patiënten met kanker1
Er zijn verschillende bijwerkingen bekend die bij behandeling met Aranesp® kunnen optreden. Hieronder vindt u de meest voorkomende.
Zeer vaak voorkomende bijwerkingen:
- overgevoeligheid
Vaak voorkomende bijwerkingen:
- oedeem
- pijn op de injectieplaats
- hypertensie
- huiduitslag, erytheem
- trombo-embolsiche voorvallen, waaronder longembolie
Soms voorkomende bijwerkingen:
- convulsies
- blauwe plek op de injectieplaats
- bloeding op de injectieplaats
Van de volgende bijwerkingen is de incidentie niet bekend:
- SJS/TEN, erythema multiforme, blaren, huidschilfering
Toediening
Aranesp® dient via de subcutane toedieningsweg te worden toegediend aan patiënten met anemie (bijv. hemoglobineconcentratie ≤ 10 g/dl (6,2 mmol/l)) om de hemoglobineconcentratie te verhogen tot maximaal 12 g/dl (7,5 mmol/l). De aanbevolen aanvangsdosering is 500 mcg (6,75 mcg/kg) toegediend eenmaal per drie weken of eenmaal per week een dosis van 2,25 mcg/kg lichaamsgewicht.1 De therapie dient ongeveer 4 weken na de chemotherapie te worden beëindigd.
Zie voor dosisaanpassingen de SmPC.
Aranesp® is beschikbaar in een voorgevulde spuit en een voorgevulde injectiepen (SureClick), voor subcutaan gebruik. Zorgverleners kunnen patiënten of hun verzorgers trainen om de injectie zelf toe te dienen, indien gewenst of nodig.1
Behandelrichtlijnen: ESMO en ASCO/ASH
Volgens de huidige behandelrichtlijnen wordt Aranesp® aanbevolen bij de behandeling van symptomatische anemie bij volwassen patiënten met non-myeloïde maligniteiten die chemotherapie [I, A] of gecombineerde RT-chemotherapie [II, B] ondergaan en een Hb waarde hebben van <10 g/dL (6,2 mmol/l), of bij volwassen patiënten met non-myeloïde maligniteiten die chemotherapie ondergaan en een Hb waarde hebben van <8 g/dL (5,0 mmol/l).2,3
Het onderstaande schema toont de criteria voor behandeling van chemotherapie-geïnduceerde anemie bij patiënten met solide of hematologische maligniteiten.
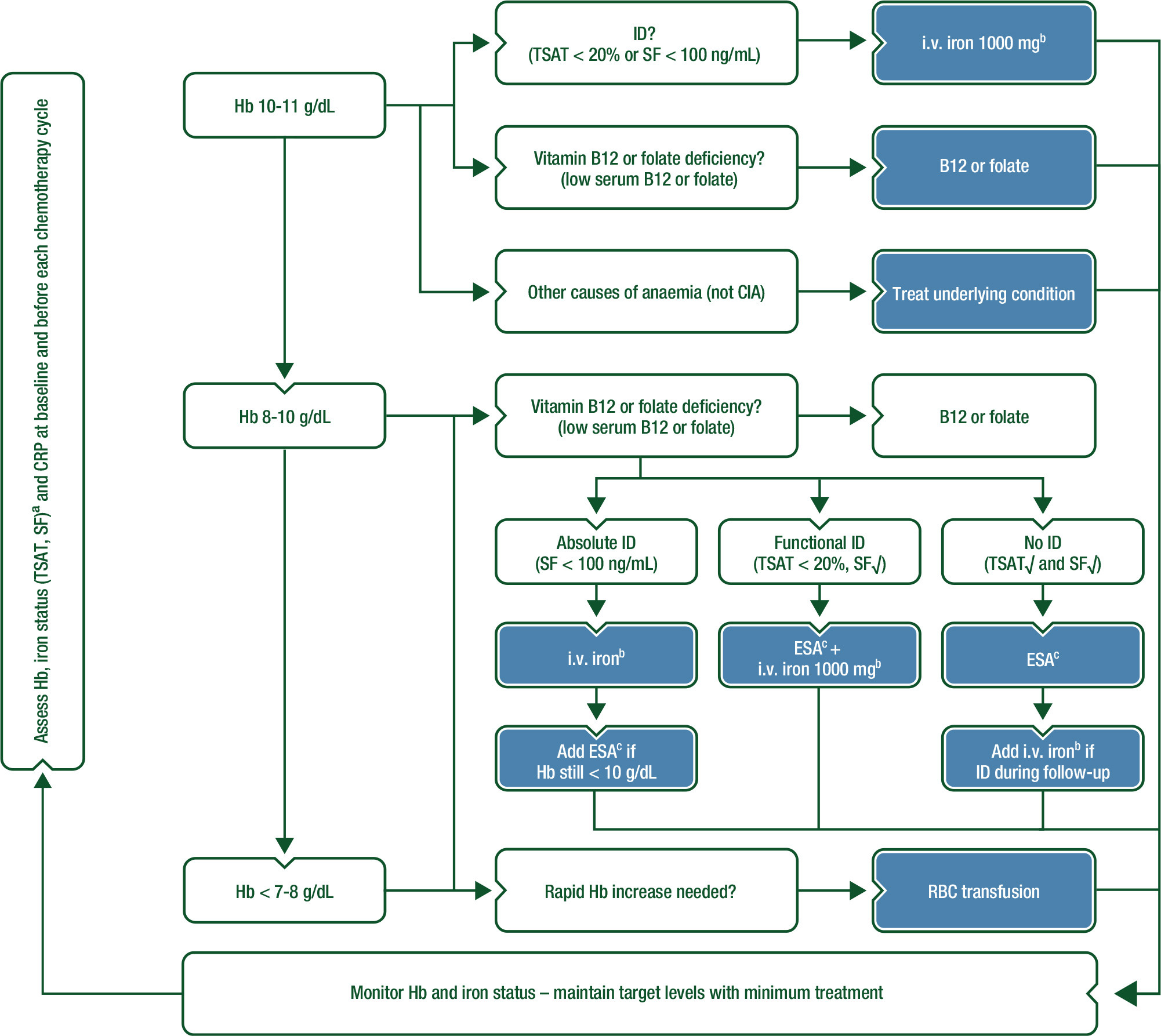
Figuur 1: Management of chemotherapy-induced anaemia in patients with solid or haematological malignancies. (Aapro 2018, pag. iv99)
aOther parameters for impaired iron status: % hypochromic cells (%HYPO) > 5% and Hb content of reticulocytes (CHr) < 28 pg. bi.v. iron given as a single dose of 1000 mg iron or an equivalent total dose in several infusions as feasible with available i.v. iron formulations. Oral iron to be considered only for patients with ferritin < 30 ng/mL and non-inflammatory conditions [CRP < 5 mg/L]. cESA dosing should follow approved labels (i.e. ∼ 450 IU/week/kg body weight for epoetins alpha, beta and zeta; 6.75 µg/kg body weight every 3 weeks or 2.25 µg/kg body weight weekly for darbepoetin alpha; 20 000 IU once weekly for epoetin theta which may be doubled after 4 weeks upon insufficient response). ESA dose escalations or a change to another ESA in patients who do not respond within 4–8 weeks are not recommended; ESA should be stopped in this case. √, normal; CIA, chemotherapy-induced anaemia; CRP, C-reactive protein; ESA, erythropoiesis-stimulating agent; Hb, haemoglobin; ID, iron deficiency; i.v., intravenous; RBC, red blood cell; SF, serum ferritin; TSAT, transferrin saturation.
-
Referenties:
- SmPC Aranesp®, voor de meest recente versie zie: https://www.ema.europa.eu/en/medicines/human/EPAR/aranesp#product-info
- Aapro M, et al. Ann Onc. 2018;29 (4):iv96-iv110.
- Bohlius J, et al. Blood Adv. 2019;3(8):1197-1210.
NLD-954-0924-80002/dec25


Literatuurservice Framingham
Framingham on anaemia in cancer biedt een samenvatting van 10 relevante artikelen uit onder andere het European Journal of Haematology, Current Oncology en Clinical and Experimental Medicine, zorgvuldig gekozen door experts verbonden aan het Máxima MC en het LUMC.
Ook bijlezen over anemie bij chemotherapie? Meld u dan nu aan.
De Framingham service is beschikbaar voor medische beroepsbeoefenaren met een BIG-registratie.
Materialen nodig?