Overzicht Kyprolis® (carfilzomib) informatie
Bijwerkingen en veiligheid carfilzomib in combinatie met dexamethason (Kd)
Deze pagina geeft een overzicht van de belangrijkste bijwerkingen van dit geneesmiddel. Voor een volledig overzicht van bijwerkingen verwijzen wij u naar de meest recente versie van de SmPC.
Melden van bijwerkingen
Het melden van ongewenste voorvallen (bijwerkingen) zodra een geneesmiddel op de markt is verschenen is belangrijk omdat het zorgt voor het continu monitoren van de benefit/risk balans van geneesmiddelen en het identificeren van mogelijke nieuwe ongewenste bijwerkingen. Het bewaken van geneesmiddel-gerelateerde ongewenste bijwerkingen is afhankelijk van beroepsbeoefenaren en gebruikers die ze rapporteren. Houd hier rekening mee wanneer dergelijke informatie onder uw aandacht wordt gebracht. U wordt eraan herinnerd dat alle ongewenste bijwerkingen op een Amgen product kunnen worden gemeld aan het Bijwerkingencentrum Lareb (www.lareb.nl) of direct aan Amgen (per e-mail dso.nl@amgen.com).


AmgenPro is uitsluitend bedoeld voor professionele zorgverleners in Nederland
Log in met uw AmgenPro account voor toegang tot content. Of maak een account aan met BIG-nummer en ontdek alle voordelen.
ENDEAVOR-studie1
De ENDEAVOR-studie is een gerandomiseerde fase 3-studie die de effectiviteit en veiligheid onderzocht van de combinatie van Kyprolis® (carfilzomib) en dexamethason (Kd) bij de behandeling van patiënten met recidief multipel myeloom. In deze studie werd de combinatie Kd vergeleken met bortezomib en dexamethason (Vd) bij patiënten die één tot drie eerdere behandelingen hadden ondergaan.
Veiligheidsresultaten1
In de tabel hieronder zijn alle graad ≥3 bijwerkingen weergeven op basis van de ENDEAVOR-studie1. Graad ≥3 bijwerkingen kwamen voor bij 82% patiënten in de Kd groep en 71% patiënten in de Vd groep.
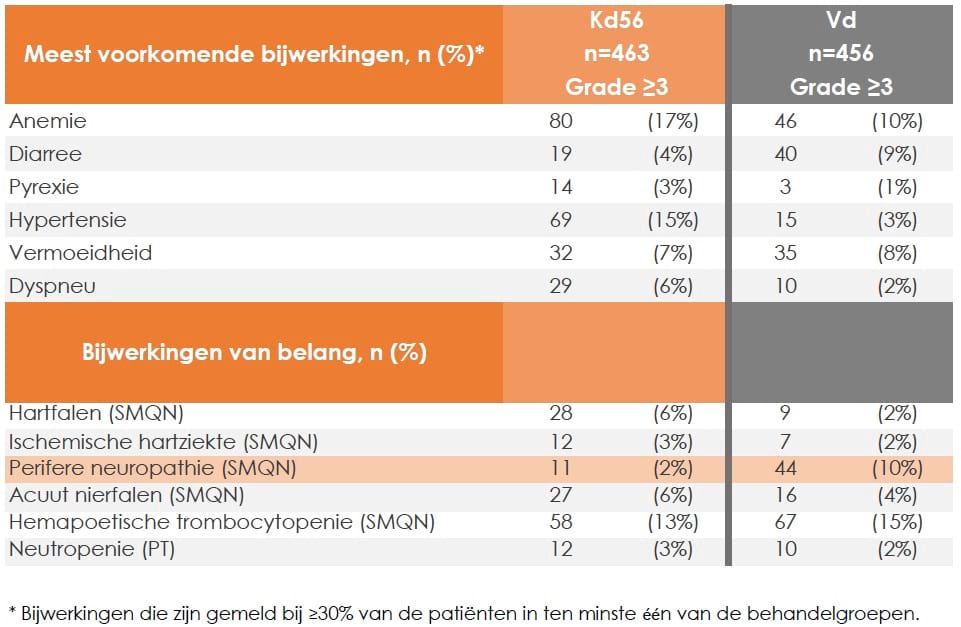
Tabel aangepast naar Orlowski RZ, et al. Clin Lymphoma Myloma leuk. 2019
Perifere neuropathie
Bij de behandeling van multipel myeloom is perifere neuropathie (in alle graden) de meest voorkomende bijwerking na de eerstelijnsbehandeling.2
Carfilzomib veroorzaakt significant minder perifere neuropathie van graad 2 of hoger ten opzichte van de Vd-groep.1
Carfilzomib veroorzaakt significant minder perifere neuropathie van graad 2 of hoger ten opzichte van de Vd-groep.1
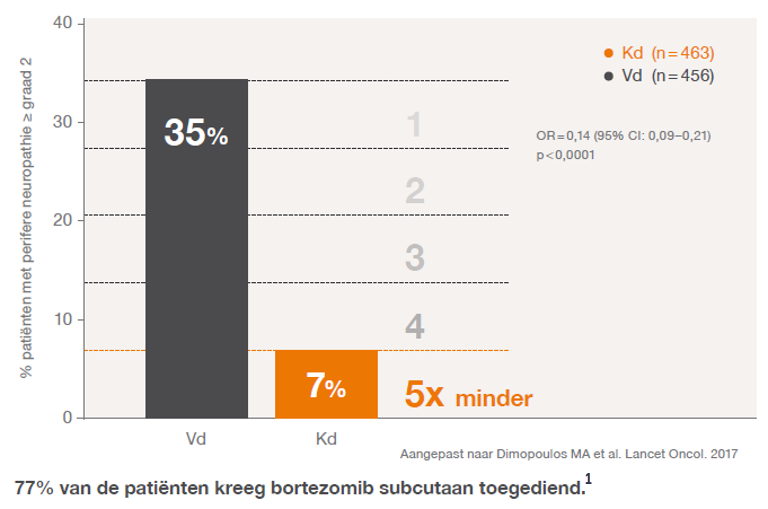
Aangepast naar Orlowski RZ, et al. Clin Lymphoma Myloma leuk. 2019
77% van de patienten kreeg bortezomib subcutaan toegediend.3
-
Voetnoten en referenties:
- Orlowski RZ, et al. Clin Lymphoma Myeloma leuk. 2019;19:522-530.
- Yong K. Brit Journal of Haem. 2016;175:252-264.
- Dimopoulus MA, et al. Lancet Oncol. 2017;18:1327-1337.
NLD-171-1224-80015/okt2025


Literatuurservice Framingham
'Framingham on multiple myeloma' biedt tweemaal per jaar een selectie van maximaal 12 één-pagina abstracts uit tijdschriften zoals American Journal of Hematology en The Lancet. Zorgvuldig gekozen door een onafhankelijk expert verbonden aan het Amsterdam UMC.
Altijd op de hoogte blijven van de nieuwste ontwikkelingen rond multipel myeloom? Meld u dan nu aan!
Framingham is beschikbaar voor medische professionals met BIG-registratie.
Materialen nodig?
















